
综述截图
8月23日,这一题为“Engineered T cells: the promise and challenges of cancer immunotherapy”的综述在线发表于Nature Reviews Cancer杂志上。宾夕法尼亚大学佩雷尔曼医学院的Andrew D. Fesnak博士和Bruce L. Levine教授是这篇文章的共同通讯作者,Carl H. June教授是本文的共同作者。
基因工程T细胞,也称为“活的药物”,是抗癌疗法中的一个新代表。近期,利用CAR-T、TCR-T(基因工程T细胞疗法的代表技术)治疗复发或难治性血液学恶性肿瘤患者的临床试验取得了惊人的结果。在这一综述中,作者们回顾了工程T细胞疗法近期的进展,并且为下一代T细胞疗法的发展提供了指导思路。
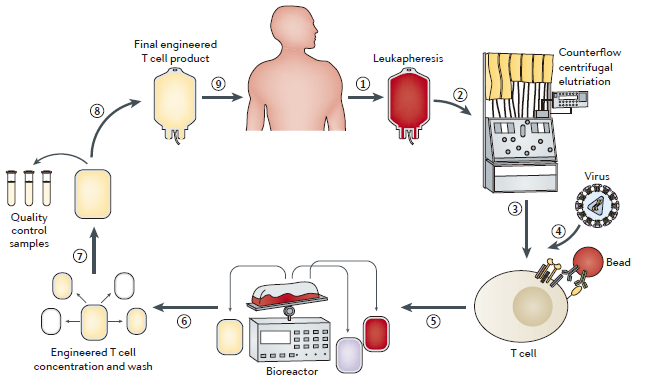
靶向B细胞恶性肿瘤的工程T细胞疗法证明了体外修改的T细胞能够消除人类肿瘤。(来源:Nature Reviews Cancer)
TCR 与 CAR
自1954年一项开创性的成果发表后,长期以来,人们认为过继转移T细胞具有靶向和摧毁癌症细胞的潜力。然而,在一些情况下,转移T细胞缺乏足够的特异性或者数量来完全“打败”肿瘤。那么,如何改善这些局限性呢?一方面,科学们开始通过基因工程手段让T细胞表达新的受体来增强肿瘤特异性。此外,体外扩增方面的进展也使得剂量不足问题得到了解决。
利用工程T细胞治疗癌症最早的临床试验依赖于克隆T细胞受体(T cell receptors ,TCRs)的表达,这些TCRs对肿瘤抗原具有靶向亲和力。TCRs既能够识别细胞内抗原,也能够识别胞外抗原,但这种广泛的识别依赖于主要组织相容性复合体(MHC)的存在。近期,科学家们开发又出了嵌合抗原受体(chimeric antigen receptors ,CARs),用于提高工程T细胞的特异性(图1)。
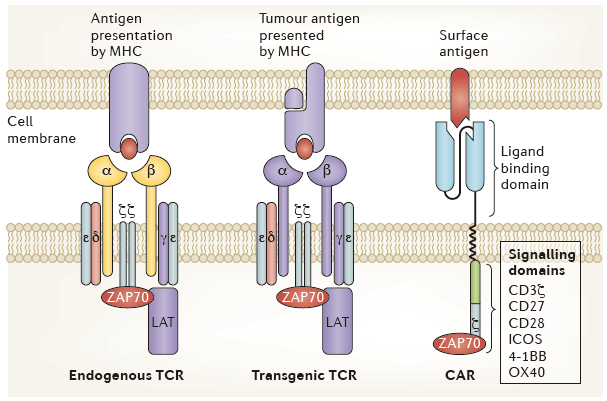
图1:Comparing basic structure of engineered T cell receptors and chimeric antigen receptors. (来源:Nature Reviews Cancer)
与TCRs不同,CARs不依赖MHC就能够高度特异性地靶向肿瘤抗原。CARs的结构实际上是包括了抗体域、配体域和TCR域。为了提高安全性和有效性,CARs的设计已经经历了几代的发展(图2)。但目前,CAR-T细胞的靶点仅局限于细胞外肿瘤抗原。
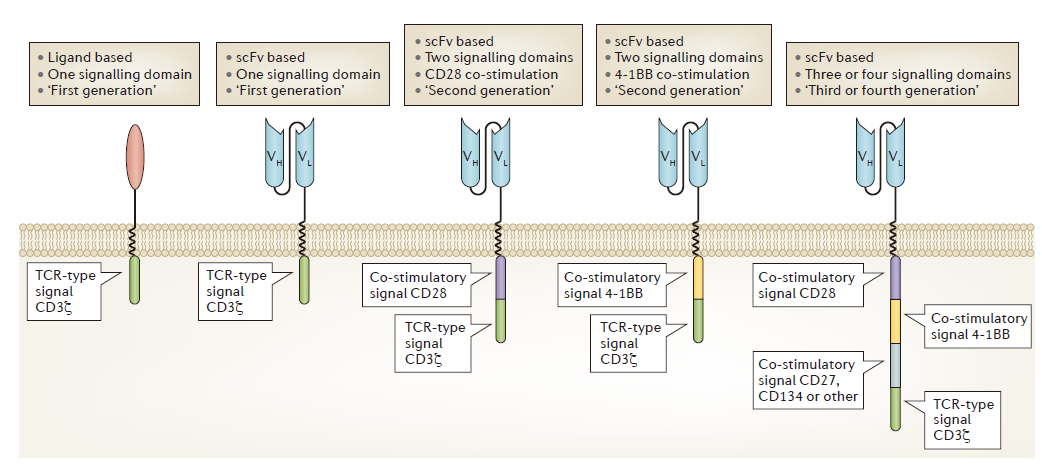
图2:Chimeric antigen receptor design and evolution. (来源:Nature Reviews Cancer)
近几年,表达工程受体的T细胞过继转移疗法为癌症治疗带来了很大的希望。靶向CD19的CAR-T疗法使难治、复发性B细胞恶性肿瘤患者获得了完全缓解。靶向NY-ESO-1的TCR-T技术也在晚期多发性骨髓瘤和滑膜细胞肉瘤中产生了临床响应。这些结果让工程T细胞疗法成为了治疗恶性肿瘤的一个新选择。
目前,科学家们正在探索这些疗法新的适应症、靶点,也在利用新的技术开发更加安全有效的T细胞疗法。在这一综述中,作者们首先回顾了工程T细胞治疗B细胞恶性肿瘤的临床试验进展;紧接着,他们重点介绍了这类疗法治疗实体瘤的靶点选择;最后,文章从四方面探讨了如何开发更“聪明”的工程T细胞。
常见适应症
B细胞恶性肿瘤是工程T细胞疗法最常见的目标肿瘤类型。这背后有几方面的原因。B细胞恶性肿瘤是相对常见的,并且表达了几个保守的细胞表面标记。循环的B细胞肿瘤为静脉注射工程T细胞提供了轻松到达的途径。截止到目前的一些研究表明,利用工程T细胞来治疗B细胞肿瘤(尤其是B细胞急性淋巴细胞白血病)具有很大的前景。
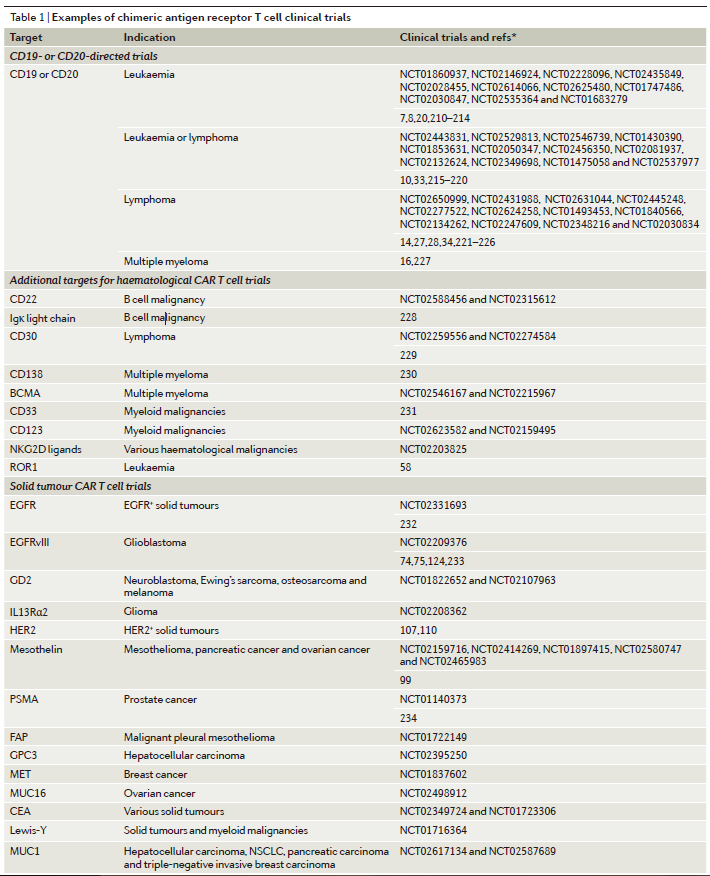
这一部分内容中,作者们主要介绍了靶向CD19的CAR-T疗法,以及针对一些新靶点(如CD20、CD22)的CAR-T疗法的近期进展(表1)。
发展方向
1.非B细胞血液学恶性肿瘤新靶点的选择
目前,有大量针对非B细胞恶性肿瘤的靶点正在被研究中(表1)。髓系恶性肿瘤的治疗在过去的几十年里一直没有进展,然而,工程T细胞疗法可能会改变这一状况。目前,科学家们正在研究可能作为T细胞疗法靶点的骨髓细胞表面的标记,如CD33、CD123(也叫IL3Rα)和 CD44v6等。
2.实体瘤靶点的选择
尽管有限的组织渗透限制了临床反应,但靶向实体瘤抗原的抗体已经取得了很大的成功。由于T细胞具有流动到几乎身体每个部位的能力,并且能够克服肿瘤免疫逃逸,因此,工程T细胞疗法也被寄予了攻克实体瘤的期望。但是,要实现这一目标,必须要找到合适的靶点。
目前,大部分有潜力的实体瘤靶点都是非特异性的,也在健康组织中表达。其中,也有一些在肿瘤组织中高度特异性表达的靶点,如EGFRvIII,但它们不会在整个肿瘤(所有肿瘤细胞)中都表达。到目前为止,工程T细胞疗法的大多数实体瘤靶点是相对非特异性的,如GD2、IL13Rα2、mesothelin、HER2等。尽管如此,科学家们依然在探索各种潜在的实体瘤靶点。(表1、表2)
3.T细胞治疗观念的演进
在这一部分内容中,作者们还强调了T细胞疗法观念的一些演变。临床上的反馈让科学家们不得不重新评估CAR-T细胞靶向选择的一些基本原则。以前的方法强调的是有效性,但现在,最小化脱靶效应(off-tumour effects)成为了靶点选择的主要驱动力。
脱靶效应可能会带来致命的影响,目前也限制着这类疗法的临床应用,尤其是治疗实体瘤。近期,一个重要的转变是,细胞内肿瘤标志物重新受到了注意。这类标志物作为靶点能够提高治疗的特异性,但脱靶识别仍有待考验。随着潜在靶点群体的扩张,更好的理解癌症生物学有望实现更精准的靶向。
让T细胞疗法更“聪明”
说了这么多,那么,未来应该从哪些方式改进T细胞疗法,让它变得更有效、更精准呢?这一综述的作者们用大量的篇幅从以下4个方向进行了总结。
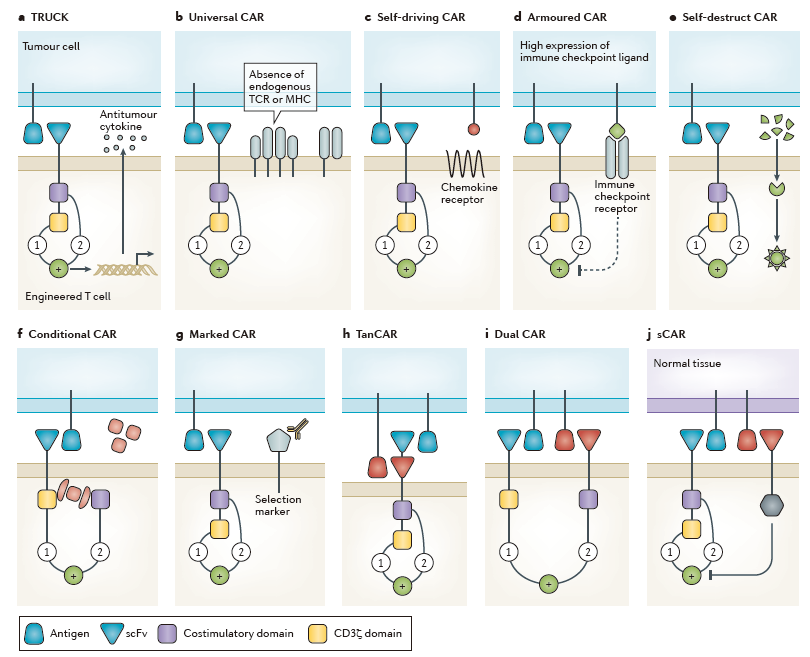
图3:New chimeric antigen receptor models and concepts.(来源:Nature Reviews Cancer)
1. 不断更新的基因改造方法
目前,应用到工程T细胞中的基因修饰技术必须平衡有效性、安全性和成本。由于强劲的有效性,基于病毒载体的方法在修改T细胞中最常被使用。随着电穿孔技术的进步,非病毒型的基因修改方法也展现出了很好的前景。
近期,最让人兴奋的是基因编辑技术的发展。包括ZFNs、TALENs和 CRISPR–Cas9在内的基因编辑技术都已被证明能够高效的编辑人类T细胞。据悉,Carl June领导的利用基于CRISPR的CAR-T技术治疗骨髓瘤、黑色素瘤和肉瘤患者的临床试验预计在今年年底启动。
2. 增强“运输”能力
工程T细胞在目标位置的定位对临床疗效至关重要,尤其是治疗实体瘤。给药途径和有效运输对保证T细胞到达靶向组织都非常关键。尽管T细胞可以迁移到几乎身体的所有部位,但局部给药的方式可能会增加工程T细胞的积累。
一些临床前实体瘤研究发现,与系统性给药相比,CAR-T细胞的局部给药在肿瘤部位有更好的积累,更能够控制肿瘤生长。此外,通过一些设计,工程T细胞的运输能力也可以被提高(图3c)。例如,趋化因子受体-配体的相互作用在调节内源性免疫细胞运输中扮演了重要的角色。
3. 避免肿瘤抑制和逃逸
恶性肿瘤能够通过免疫逃逸或者肿瘤微环境中的免疫抑制对工程T细胞疗法产生抵抗。这种免疫抑制可以通过多种机制产生,包括细胞-细胞信号(cell–cell signalling)和可溶性细胞因子的释放。
目前,有多种方法可以应用到工程T细胞中,用以“对付”肿瘤的免疫抑制(图3d)。举例来说,临床前研究发现,添加PD-1抗体能够增强CAR-T细胞的功能。目前,有很多团队在尝试与PD-1-PD-L1或CTLA4-CD80/CD86信号相关的CAR-T疗法研究。为了进一步提高疗效,未来,T细胞疗法可能会结合多种形式的免疫检查点阻断。
4.提高安全性
尽管治疗相关的死亡率远低于常规治疗,但工程T细胞回输也带来了严重的不良反应,包括细胞因子释放综合征、交叉反应等。作者们指出,利用分子“开关”能够对工程T细胞在体内的“表现”有更好的控制,有望提高这类疗法的安全性。
具体来说,一种是“关闭开关(off switch)”,是指对T细胞进行设计,使其表达一种能够通过外源元素诱导表达的促死亡信号(图3e);另一种是“打开开关(on switch)”,是指让T细胞在另一外源分子存在时才能激活(图3f)。
为了改善安全性,工程T细胞也可以用独特的细胞表面分子进行标记,这些分子的特性是可以与被批准的单抗相结合。如果这个分子(抗原)也在肿瘤细胞中表达,用相应的单抗治疗肿瘤时也能够消除CAR-T细胞介导的不良反应(图3g)。
另一方面,脱靶(Off-tumour)毒性可以通过增强CAR-T细胞的特异性来预防。例如,让CAR-T细胞只有在响应特定的靶点组合时才能被激活,类似于双特异性抗体的概念(图3h)。作者们表示,这些嵌入细胞药物中的新分子系统将提高工程T细胞疗法的特异性和安全性,以及最小化脱靶效应。